Какие химические вещества в воде нерастворимы. Водные растворы. Растворы заводского изготовления. Технология лекарств заводского производства. Технология лекарств. Фармация
К водным растворам относятся малоконцентрированные насыщенные растворы неорганических веществ, а также ароматные воды, не содержащие спирта.
Жидкость Бурова. Представляет собой водный раствор основного ацетата алюминия концентрацией 7,6-9,2% и плотностью 1,044-1,048. Раньше жидкость Бурова получали с помощью реакции образования гидрата окиси алюминия с его последующим растворением в уксусной кислоте. В последние годы ее производят методом электролиза, разработанным А. И. Коноваловой. В основе его лежит процесс анодного растворения металлического алюминия в 8% растворе уксусной кислоты при пропускании через него электрического тока. В результате протекает реакция образования основного ацетата алюминия.
Раствор ацетата свинца основного. Свинцовый уксус. Представляет собой водный раствор ацетата свинца основного с содержанием металлического свинца 16,7-17,4% и плотностью 1,225-1,230. При стоянии на воздухе раствор мутнеет вследствие интенсивного поглощения углекислоты воздуха. Препарат получают взаимодействием ацетата свинца и окиси свинца при нагревании. 3. П. Беридзе предложил получать раствор основного ацетата свинца из окиси свинца и уксусной кислоты.
Сам по себе раствор основного ацетата свинца не применяется. Из него готовят в аптеках свинцовую примочку по прописи: 2 части ацетата свинца основного и 98 частей воды. Свинцовая примочка, как и жидкость Бурова, является вяжущим и противовоспалительным средством.
Известковая вода. Раствор гидроокисикальция. Известковая вода - это насыщенный водный раствор гидроокиси кальция концентрацией 0,15-0,17%. Получают реакцией гашения жженой извести (кальция окиси) с последующим насыщением раствора гидроокиси кальция на холоду. Готовый препарат представляет собой прозрачную бесцветную жидкость сильно щелочной реакции. Его применяют внутрь в смеси с молоком в детской практике при повышенной кислотности желудочного сока и поносе.
Раствор калия арсенита. Фаулеров раствор мышьяка. Официальный раствор, представляющий собой водный раствор мышьяковистого ангидрида (которого в препарате должно быть 0,97-1,03%) в смеси с калия карбонатом.
Для получения раствора калия арсенита 10 частей калия карбоната растворяют в 10 частях кипящей воды, прибавляют 10 частей мышьяковистого ангидрида и жидкость нагревают до кипения (до полного растворения). Далее раствор разбавляют 500 г воды и при перемешивании постепенно добавляют разведенной соляной кислоты до нейтральной реакции раствора, что необходимо для предупреждения образования других солей мышьяка. После нейтрализации к раствору добавляют 90 частей спирта (по объему) и 10 частей камфорного спирта (по объему). Раствор калия арсенита - препарат списка А. Камфорный спирт добавляют в него с целью быстрого и легкого органолептического опознания.
Сохраняют препарат под замком (шкаф А), в хорошо закупоренных склянках темного стекла. Его назначают при малокровии, неврастении, истощении и хроническом лейкозе.
Ароматные воды. Представляют собой слабоконцентрированные растворы эфирных масел в воде. Это прозрачные или слабо опалесцирующие жидкости, обладающие запахом растворенного вещества. За редким исключением (укропная и горькоминдальная вода), они не имеют самостоятельного лекарственного назначения и применяются как корригирующие средства (для исправления запаха).
В зависимости от способа получения различают простые и перегнанные ароматные воды.
Простые ароматные воды получают непосредственным растворением соответствующего эфирного масла в воде в соотношении 1:1000 (за исключением розовой воды, которую вследствие сильной пахучести розового масла готовят в соотношении 1:4000). Перед растворением эфирное масло растирают с тальком и растворяют в теплой (до 60°) воде. Обе операции необходимы для улучшения процесса растворения. Избыток масла в растворе отфильтровывают через влажный фильтр.
Для повышения стабильности простых ароматных вод к ним рекомендуется добавлять ПАВ, играющие роль солюбилизаторов: твины, спены, этилстеараты и другие вещества, улучшающие растворимость.
Перегнанные ароматные воды готовят методом перегонки, заключающимся в пропускании «острого» водяного пара через эфирномасличное сырье. Процесс перегонки с водяным паром основан на законе Дальтона, в соответствии с которым две несмешивающиеся жидкости перегоняются при более низкой температуре, чем каждая в отдельности, поскольку образование пара таких смесей протекает при равенстве суммы парциальных давлений компонентов смеси и атмосферного давления.
Для получения ароматных вод в перегонный куб помещают эфирномасличное сырье, через которое пропускают водяной пар, увлекающий вместе с собой в конденсатор эфирное масло. В конденсаторе, охлаждаемом холодной водой, пары воды и эфирного масла конденсируются и стекают в приемник в виде готовой ароматной воды. В случае, если при перегонке образуется излишек эфирного масла, не растворяющийся в воде, его сливают в отдельные приемники.
Из перегнанных ароматных вод в фармацевтической практике более или менее широкое применение находят горько-миндальная вода и укропная вода, применяемые внутрь с целью улучшения функций кишечника.
Ароматные воды готовят и на спирте. В этом случае концентрация эфирного масла в них может быть увеличена.
13.1. Растворимость веществ в воде
Раствор – это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Водные растворы состоят из воды (растворителя) и растворенного вещества. Состояние веществ в водном растворе при необходимости обозначается нижним индексом (р), например, KNO 3 в растворе – KNO 3(p) .
Растворы, которые содержат малое количество растворенного вещества, часто называют разбавленными, а растворы с высоким содержанием растворенного вещества – концентрированными. Раствор, в котором возможно дальнейшее растворение вещества, называется ненасыщенным, а раствор, в котором вещество перестает растворяться при данных условиях, – насыщенным. Последний раствор всегда находится в контакте (в гетерогенном равновесии) с нерастворившимся веществом (один кристалл или более).
В особых условиях, например при осторожном (без перемешивания) охлаждении горячего ненасыщенного раствора твердого вещества, может образоваться пересыщенный раствор. При введении кристалла вещества такой раствор разделяется на насыщенный раствор и осадок вещества.
В соответствии с химической теорией растворов Д. И. Менделеева растворение вещества в воде сопровождается, во-первых, разрушением химических связей между молекулами (межмолекулярные связи в ковалентных веществах) или между ионами (в ионных веществах), и, таким образом, частицы вещества смешиваются с водой (в которой также разрушается часть водородных связей между молекулами). Разрыв химических связей совершается за счет тепловой энергии движения молекул воды, при этом происходит затрата энергии в форме теплоты.
Во-вторых, попав в воду, частицы (молекулы или ионы) вещества подвергаются гидратации. В результате образуются гидраты – соединения неопределенного состава между частицами вещества и молекулами воды (внутренний состав самих частиц вещества при растворении не изменяется). Такой процесс сопровождается выделением энергии в форме теплоты за счет образования новых химических связей в гидратах.
В целом раствор либо охлаждается (если затрата теплоты превосходит ее выделение), либо нагревается (в противном случае); иногда – при равенстве затраты теплоты и ее выделения – температура раствора остается неизменной.
Многие гидраты оказываются настолько устойчивыми, что не разрушаются и при полном выпаривании раствора. Так, известны твердые кристаллогидраты солей CuSO 4 5Н 2 O, Na 2 CO 3 10Н 2 O, KAl(SO 4) 2 12Н 2 O и др.
Содержание вещества в насыщенном растворе при Т = const количественно характеризует растворимость этого вещества. Обычно растворимость выражается массой растворенного вещества, приходящейся на 100 г воды, например 65,2 г КBr/100 г Н 2 O при 20 °C. Следовательно, если 70 г твердого бромида калия ввести в 100 г воды при 20 °C, то 65,2 г соли перейдет в раствор (который будет насыщенным), а 4,8 г твердого КBr (избыток) останется на дне стакана.
Следует запомнить, что содержание растворенного вещества в насыщенном растворе равно , в ненасыщенном растворе меньше и в пересыщенном растворе больше его растворимости при данной температуре. Так, раствор, приготовленный при 20 °C из 100 г воды и сульфата натрия Na 2 SO 4 (растворимость 19,2 г/100 г Н 2 O), при содержании
15,7 г соли – ненасыщенный;
19.2 г соли – насыщенный;
2O.3 г соли – пересыщенный.
Растворимость твердых веществ (табл. 14) обычно увеличивается с ростом температуры (КBr, NaCl), и лишь для некоторых веществ (CaSO 4 , Li 2 CO 3) наблюдается обратное.
Растворимость газов при повышении температуры падает, а при повышении давления растет; например, при давлении 1 атм растворимость аммиака составляет 52,6 (20 °C) и 15,4 г/100 г Н 2 O (80 °C), а при 20 °C и 9 атм она равна 93,5 г/100 г Н 2 O.
В соответствии со значениями растворимости различают вещества:
– хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (например, КBr – при 20 °C растворимость 65,2 г/100 г Н 2 O; 4,6М раствор), они образуют насыщенные растворы с молярностью более чем 0,1М;
– малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (например, CaSO 4 – при 20 °C растворимость 0,206 г/100 г Н 2 O; 0,015М раствор), они образуют насыщенные растворы с молярностью 0,1–0,001М;
– практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя (например, AgCl – при 20 °C растворимость 0,00019 г на 100 г Н 2 O; 0,0000134М раствор), они образуют насыщенные растворы с молярностью менее чем 0,001М.
По справочным данным составлена таблица растворимости распространенных кислот, оснований и солей (табл. 15), в которой указан тип растворимости, отмечены вещества, не известные науке (не полученные) или полностью разлагающиеся водой.
Условные обозначения, используемые в таблице:
«р» – хорошо растворимое вещество
«м» – малорастворимое вещество
«н» – практически нерастворимое вещество
«-» – вещество не получено (не существует)
» – вещество смешивается с водой неограниченно
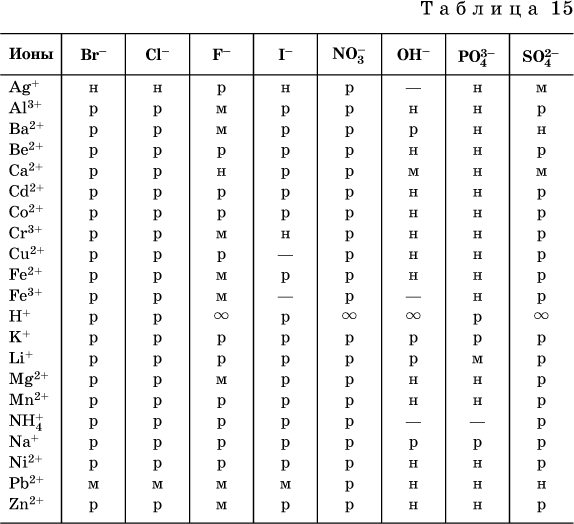
Примечание. Данная таблица отвечает приготовлению насыщенного раствора при комнатной температуре путем внесения вещества (в соответствующем агрегатном состоянии) в воду. Следует учесть, что получение осадков малорастворимых веществ с помощью реакций ионного обмена возможно не всегда (подробнее см. 13.4).
Раствор - жидкая лекарственная форма, полученная путем растворения одного или нескольких лекарственных веществ, предназначенная для инъекционного, внутреннего или наружного применения. В физико-химическом отношении растворы не являются однородной группой, поскольку они охватывают жидкие дисперсные системы с разной степенью дисперсности: 1) истинные растворы низкомолекулярных соединений; 2) растворы высокомолекулярных соединений и 3) коллоидные растворы. За всеми этими категориями дисперсных систем издавна закрепилось одно общее наименование растворы (например, раствор натрия хлорида, раствор протаргола, раствор желатина), хотя каждая система имеет свои особенности.
Растворы представляют самую обширную группу среди жидких лекарственных форм. В биофармацевтическом отношении растворы обладают рядом достоинств. Основные из них: а) лекарственные вещества из растворов быстрее всасываются и скорее оказывают резорбтивное действие; б) исключается раздражающее действие на слизистые оболочки, которое имеет место при приеме порошков (например, бромидов и йодидов калия, аммония и др.); в) удобны для приема; г) быстро изготавливаются. Однако растворы как лекарственные формы не лишены некоторых недостатков. Так, не все категории растворов отличаются устойчивостью при хранении, в форме раствора более отчетливо ощущается неприятный вкус некоторых лекарственных веществ.
Истинные растворы охватывают все категории дисперсных систем: молекулярно-дисперсные и ионно-дисперсные системы. В молекулярно-дисперсных системах размер частиц порядка 1 нм. К ним относятся растворы неэлектролитов (например, сахар, спирт). Растворенное вещество распадается на отдельные кинетические самостоятельные молекулы. В ионнодисперсных системах размер частиц выражается числами уже порядка 0,1 нм. К ним относятся растворы электролитов (например, натрия хлорид, магния сульфат). Растворенное вещество находится в виде отдельных гидратированных ионов и молекул в некоторых равновесных количествах.
Истинные растворы являются однофазными системами, они гомогенны даже при рассматривании их в электронном микроскопе, и их компоненты не могут быть разделены ни фильтрованием, ни каким-либо другим способом. Истинные растворы хорошо диффундируют, сохраняют гомогенность длительное время, если только в них не начинают происходить вторичные химические процессы (гидролиз, окисление и т. п.) или они не подвергаются микробиологическому загрязнению. Эта устойчивость очень важна в практическом отношении, поскольку позволяет приготавливать в запас раствор-концентраты для бюреточных установок и внутри аптечные заготовки.
Важнейшей особенностью процесса растворения является его самопроизвольность. Достаточно простого соприкосновения растворяемого вещества с растворителем, чтобы через некоторое время образовалась однородная система-раствор.
При выборе растворителя приходится пользоваться преимущественно эмпирическими правилами, поскольку предложенные теории растворимости не всегда могут объяснить сложные (как правило) соотношения между составом и свойствами растворов. Чаще руководствуются старинным правилом: «подобное растворяется в подобном» («Similia similibus solventur»). Практически это означает, что для растворения какого-либо вещества наиболее пригодными являются те растворители, которые структурно сходны и, следовательно, обладают близкими физико-химическими свойствами.
С современной точки зрения, это эмпирическое правило в значительной степени может быть объяснено наличием (или отсутствием) у растворителя и растворяемого вещества полярных групп. Полярные группы - это активные функциональные группы, присутствующие в химических соединениях, способные образовывать соответствующие связи между контактируемыми веществами. Полярными функциональными группами являются, например, группы ОН, СО, СНО, СООН, NH2. Следовательно, жидкости, имеющие указанные группы (вода, этанол, глицерин и т. п.), хорошо смешиваются, т. е. взаимно растворяются. К неполярным растворителям относятся жидкости, не имеющие активных функциональных групп, например углеводороды (вазелиновое масло), галоидоалкилы (хлороформ, СНСl3 и др.).
Растворимость жидкостей в жидкостях колеблется в широких пределах. Наряду с жидкостями, неограниченно растворяющимися друг в друге (например, этанол и вода), имеются жидкости, ограниченно растворимые друг в друге (например, эфир и вода - малополярное и полярное вещества), и жидкости, практически нерастворимые друг в друге (например, растительные масла и вода, этанол, глицерин - неполярные и полярные вещества).
Наличием полярных групп только в некотором приближении объясняется растворимость того или иного вещества в том или ином растворителе. Это объяснение не всегда приемлемо, особенно в отношении органических соединений: в этих случаях на растворимость вещества оказывают влияние различные конкурирующие функциональные группы, их число, молекулярная масса, размер и форма молекулы и другие факторы.
Лекарственные вещества обладают разной способностью к растворению в воде и других растворителях. Сведения о растворимости приводятся в частных статьях ГФХ и в специальных таблицах которые должны иметься в каждой аптеке. В этих таблицах принят обычный массообъемный способ обозначения растворимости, т. е. обозначение, например, 1:20 говорит о том, что в 20 мл растворителя может раствориться не более 1 г данного вещества. Часто растворимость обозначается процентной концентрацией вещества (для нашего примера - 5%).
Растворимость данного лекарственного вещества в воде (и другом растворителе) зависит от температуры. Для подавляющего большинства твердых веществ растворимость увеличивается с повышением температуры. Бывают, однако, исключения (например, соли кальция).
Некоторые лекарственные вещества растворяются медленно (хотя и растворяются в значительных концентрациях). С целью ускорения растворения таких веществ прибегают к нагреванию, предварительному измельчению растворяемого вещества, перемешиванию смеси.
Водные растворы
Растворы твердых лекарственных веществ
Процесс растворения твердого кристаллического вещества в воде состоит из двух одновременно протекающих процессов: сольватации (в случае воды - гидратации) частиц и разрушения кристаллической решетки. На рис. 9.1 показан процесс растворения натрия хлорида в воде. Ионы натрия Na+ и хлорида Сl-, находящиеся на поверхности кристаллов NaCl, гидратируются дипольными молекулами воды: к положительному иону натрия диполи воды обращены своими отрицательными полюсами, а к отрицательным ионам хлора - положительными. Между ионами и полярными молекулами воды возникает ионно-дипольная связь, в результате чего диполи проникают между ионами Na+ и Cl- в твердой фазе, отрывая их от кристалла. Совершенно очевидно, что эффективность растворения выше, когда силы сцепления между молекулами растворителя и частицами растворяемого вещества больше сил взаимного притяжения этих частиц между собой. Молекулы воды по сравнению с молекулами других растворителей обладают очень выраженной полярностью. Именно этим свойством обусловливаются высокая ионизирующая способность воды и ее разрушительное действие на кристаллические решетки многих полярных соединений.
При растворении веществ наблюдается поглощение или выделение теплоты. Поглощение теплоты указывает на затрату энергии. Объясняется это тем, что на перевод вещества из твердого состояния в раствор, т. е. на разрушение кристаллической решетки, обязательно расходуется энергия, которая отнимается у растворителя, в результате чего происходит охлаждение раствора. Величина охлаждения раствора тем выше, чем прочнее кристаллическая решетка, т. е. чем больше энергии требуется на ее разрушение. Выделение тепла при растворении веществ всегда указывает на активно протекающую сольватацию, т. е. образование соединений между растворимым веществом и растворителем.
С заметным поглощением теплоты растворяются, например, калия нитрат, калий йодид, натрия хлорид, с малозаметным - натрия бромид. С выделением теплоты растворяются серебра нитрат, гидроксид кальция, кальция хлорид и др.
Растворение подавляющего большинства твердых веществ, как уже указывалось, носит самопроизвольный характер, особенно в тех случаях, когда в прописываемых растворах концентрация лекарственных веществ далека до предела, например:
9.1. Rp.: Kalii iodidi 10,0
Aquae destillatae 200 ml
MDS. По 1 столовой ложке 2-3 раза в день
При растворимости калия йодида 1:0,75 (т. е. для растворения 1 г соли требуется меньше 1 мл воды) в системе имеется огромный запас растворимости. Однако во многих случаях по разным причинам процесс растворения нуждается в активации и применении особых технологических приемов.
Растворы веществ, обладающих хорошей, но медленной растворимостью. Медленно растворяются в воде амидопирин, кофеин, меди сульфат и др.
9.2. Rp.: Solutionis Amidopyrini 1% 200 ml
Sirupi simplicis 10 ml
MDS. По 1 десертной ложке через 2-3 ч
Растворимость амидопирина 1:20 (5%). Однако поверхность его кристаллов плохо смачивается водой, что задерживает растворение. Смачиваемость можно улучшить, а следовательно, и ускорить растворение амидопирина применением горячей воды.
Плохой смачиваемостью обладают также квасцы, кислота борная, натрия тетраборат. Их также растворяют в горячей воде. Кристаллы солей тяжелых металлов, помимо плохой смачиваемости, имеют прочные кристаллические решетки. В этом случае приходится использовать все возможные приемы: горячую воду, растирание в ступке с растворителем.
9.3. Rp.: Cupri sulfatis 0,5
Aquae destillatae 50 ml
MDS. По 1 столовой ложке через 10 мин до наступления рвоты
Растворимость сульфата меди в воде хорошая (1:3), однако вследствие указанных выше причин растворение ускоряют растиранием в ступке с горячей водой.
9.4. Rp.: Solutionis Hydrargyri dichloridi 1:2000-200 ml
DS. Для промывания
Растворимость ртути дихлорида в воде 1:18,5. Однако в связи с медленной растворимостью сулемы в холодной воде следует пользоваться горячей водой. Другой особенностью раствора ртути дихлорида является кислая реакция, которую он приобретает вследствие гидролиза. Поэтому после растворения сулемы добавляют равное количество натрия хлорида, который приостанавливает гидролиз, и раствор приобретает нейтральную реакцию и устойчивость. Еще одна особенность этого раствора - осторожность приготовления и оформления перед его отпуском. Раствор подкрашивают эозином (с указанием в сигнатуре) и отпускают в опечатанном виде с предупредительными этикетками на флаконах «Яд», «Обращаться с осторожностью», «Раствор сулемы 0,5%» и этикеткой с изображением скрещенных костей и черепа. Растворы сулемы целесообразнее приготавливать из таблеток, выпускаемых промышленностью по 0,5 и 1,0, содержащих равное количество хлорида натрия и подкрашенных 1% раствором эозина.
9.5. Rp.: Solutionis Phenoli puri 2% 200 ml
DS. Для промывания
Кристаллический фенол очень медленно растворяется в воде. Для удобства изготовления его водных растворов исходят из жидкого фенола (Phenolum purum liquefactum). Последний получается путем добавления к 100 г фенола расплавленного на водяной бане 10 мл воды. Бесцветная маслянистая жидкость, содержащая около 90% фенола, не смешивается с жирными маслами. Исходя из этой цифры, отмеривают 4,4 мл жидкого фенола и доводят объем раствора до 200 мл. Отпускают с этикетками «Яд», «Обращаться с осторожностью», «Карболовая кислота», если растворы фенола имеют концентрацию свыше 5%.
Растворы веществ, требующие добавления ингредиентов, способствующих растворению и стабильности растворов. Эта группа растворов довольно обширна, и изготовление каждого раствора имеет свои особенности.
Так, например, водные растворы йода в лечебных концентрациях (от 1 % и выше) можно получить в присутствии калия йодида за счет образования легкорастворимых комплексных соединений йода с йодидами щелочных металлов (образуются перйодиды): I2 + KI > КI3
9.6. Rp.: Iodi 1,0
Kalii iodidi 2,0
Aquae destiilatae ad 100 ml
MDS. Раствор Люголя для наружного применения
Изготовление сводится к получению концентрированного раствора калия йодида: достаточно взять 1,5-2 мл воды (растворимость 1:0,75) и добавить йод, который растворится почти мгновенно. По этому же принципу изготавливаются и раствор ртути дийодида, растворимость которого 1:25 000, а в присутствии калия йодида образуется легкорастворимый комплекс K2HgI4.
Очень мало растворимый в воде препарат мышьяка - осарсол - переводится в раствор с помощью натрия гидрокарбоната. Протекает обменная реакция и образуется водорастворимая натриевая соль осарсола.
9.7. Rp.: Solutionis Osarsoli 5% 200 ml
Natrii hydrocarbonatis 4,0
MDS. Для влагалищного обтирания
Приготавливают раствор натрия гидрокарбоната, в котором растворяют осарсол. Лекарственная форма предназначена для наружного применения, оформляют ее, как содержащую ядовитое вещество.
Своеобразно и приготовление растворов темисала, представляющего собой сочетание эквимолекулярных количеств натриевых солей салициловой кислоты и теобромина. Натрия салицилат повышает растворимость теобромина, который практически нерастворим в воде и вытесняется из солей даже слабой угольной кислотой. По этой причине растворителем должна быть только свежепрокипяченная, лишенная углекислого газа, дистиллированная вода. В противном случае часть теобромина выпадает в осадок, и раствор будет испорчен. Темисал образует прозрачные сильно щелочные растворы, хорошо поглощающие углекислый газ. По этой причине флакон с изготовленным раствором немедленно плотно закупоривают. В процессе применения раствор может мутнеть и образовываться небольшой осадок. Поэтому обязательна этикетка «Перед употреблением взбалтывать», а больной должен быть дополнительно предупрежден об этой особенности применения.
Растворы жидких лекарственных веществ
В форме водных растворов обычно применяются жидкие лекарственные вещества, обладающие полной взаимной растворимостью, но могут быть прописаны и вещества с ограниченной растворимостью в воде. В случае растворения в воде полярных соединений происходит гидратация полярных молекул и диссоциация этих молекул в растворе на свободные гидратированные ионы (см. рис. 9.1). Например, так ведут себя молекулы НСl, диссоциирующие в водных растворах на свободные гидратированные ионы Н+ и Сl-.
Растворы кислот. При использовании в аптечной практике неорганических и сильных органических кислот необходимо помнить, что при разведении крепких кислот последние вводят в растворитель понемногу, тонкой струей, помешивая, для предупреждения выброса кипящей смеси и ожога. При приготовлении водных растворов кислот во избежание ошибок в толковании рецептов необходимо строго руководствоваться в каждом отдельном случае указаниями ГФХ, например:
9.8. Rp.: Acidi hydrochlorici 15 ml
DS. Принимать по 10-15 капель на 1/4 стакана воды 2 раза в день во время еды
В ГФХ (ст. 20) говорится, что если прописана хлористоводородная кислота и не указана ее концентрация, то всегда имеется в виду разведенная кислота (Acidurn hydrochloricum dilutum), содержащая 8,2-8,4% хлористого водорода. Так следует поступить и при изготовлении раствора по рецепту 9.8.
Однако хлористоводородная кислота как таковая прописывается редко, поскольку даже при содержании в ней 8% хлористого водорода она летуча. Поэтому обычно прописывают растворы разведенной кислоты.
9.9. Rp.: Solutionis Acidi hydrochlorici 2% 200 ml
DS. По столовой ложке 2 раза в день во время еды
В ГФХ говорится, что в таких случаях фармакопейная разведенная кислота принимается за единицу (стандартный препарат) и ее берется столько, сколько указано в рецепте. В данном случае требуется 4 мл препарата и 196 мл воды. Однако, учитывая летучесть хлористого водорода, и для повышения точности приготавливаемых растворов рекомендуется пользоваться внутриаптечной заготовкой: Sol. Acidi hydrochlorici diluti 1:10. В этом случае берется 40 мл раствора разведенной хлористоводородной кислоты и 160 мл дистиллированной воды.
Из сильных органических кислот могут назначаться 5-8% растворы уксусной кислоты для наружного применения (обтирания). Здесь используется другое правило - процентное содержание уксусной кислоты, указанное в рецепте, должно быть точно воспроизведено в растворе. Исходная кислота может быть разведенная (30%) или концентрированная (98%). При приготовлении, например, 5% раствора уксусной кислоты можно исходить из обоих препаратов, но в каждом случае нужно точно рассчитывать их количества, чтобы обеспечить требуемое содержание 5% уксусной кислоты. Естественно легче разбавить 30% уксусную кислоту.
Растворы аммиака. Если выписан раствор аммиака без указания концентрации, то всегда имеется в виду фармакопейный препарат, содержащий 10% аммиака (Solutio Ammonii caustici), - нашатырный спирт (ГФХ, ст. 464). Исходя из этого стандартного препарата, отпускают его растворы, разведя его до требуемой по рецепту концентрации аммиака (обычно значительно меньшей 1% для вдыхания при обмороке). При расчете разведения необходимо знать фактическое содержание аммиака в препарате, поскольку оно не всегда стабильно.
Растворы перекиси водорода. Раствор перекиси водорода часто назначается для полосканий. В этом случае нужно иметь в виду, что если будет прописан Solutio Hydrogenii peroxydi без указания концентрации, то в соответствии с указаниями ГФХ (ст. 496) следует отпускать фармакопейный препарат Solutio Hydrogenii peroxydi diluta, содержащий 3% перекиси водорода. Если же будет прописан раствор меньшей концентрации, то указанный фармакопейный препарат нужно соответственно разбавить. В ряде случаев, например для смазывания десен, прописываются растворы перекиси водорода большей, чем 3%, концентрации. В этом случае нужно исходить из пергидроля (Solutio Hyrogenii peroxydi concentrate, ГФХ, ст. 495), содержащего 27,5-31% перекиси водорода.
9.10. Rp.: Solutionis Hydrogenii peroxydi 0,5% 200 mi
DS. Полоскание
9.11. Rp.: Solutionis Hydrogenii peroxydi 6% 50 ml
DS. Для смазывания десен
Так, по рецепту 9.10 смешивают 33,3 мл раствора перекиси водорода (3%) и 166,7 мл воды, а по рецепту 9.11 - 10 мл пергидроля и 40 мл воды, при условии, что в пергидроле содержится 30% перекиси водорода. Если фактическое содержание водорода меньше (что часто бывает), то расчет следует вести по ее фактическому содержанию.
Растворы формалина. Здесь также очень важно правильное толкование рецепта. «Формалин» - это традиционное название фармакопейного препарата «Solutio Formaldehydi» (ГФХ, ст. 489), который должен содержать не менее 36% и не более 40% газообразного альдегида муравьиной кислоты. Формалин может прописываться как таковой (в этом случае просто отмеривают препарат) или в форме раствора (формалин - сильное дезинфицирующее средство).
9.12. Rp.: Solutionis Formalini 50% 50 ml
DS. Для смазывания
В этом случае, согласно указания ГФХ, фармакопейный препарат принимается за единицу и его берется столько, сколько указано в рецепте: 25 мл формалина и 25 мл воды. ГФХ допускает применение формалина с содержанием формальдегида менее 36%, но с внесением соответствующей поправки.
В рецепте может быть прописан раствор с конкретным указанием содержания в нем формальдегида, например:
9.13. Rp.: Solutionis Formaldehydi 5% 200 ml
DS. Для обмывания ног
В этом случае производят расчет, исходя из фактического содержания формальдегида в исходном препарате. Если по анализу препарат содержал точно 40% формальдегида, то следует взять 25 мл раствора формальдегида и 175 мл воды.
Растворы жидкости Бурова. Жидкость Бурова содержит 8% основного ацетата алюминия. Применяется в качестве антисептического средства. Здесь затруднение может вызвать не процесс смешения двух жидкостей (воды и препарата), а толкование требуемых концентраций по рецептам. Следует иметь в виду, что раствор жидкости Бурова одной и той же концентрации может быть прописан по-разному (рецепты 9.14-9.16). Во всех случаях прописан раствор, содержащий 0,8% основного ацетата алюминия, и во всех случаях берется по 10 мл жидкости Бурова.

Растворы твердых и жидких лекарственных веществ (совместно)
Такие растворы в аптечной практике встречаются очень часто и порою бывают достаточно сложными. Во всех случаях вначале изготавливается раствор твердых веществ, в который затем добавляются жидкие лекарственные препараты (настойки, жидкие экстракты, новогаленовы препараты, сиропы и т. п.).
9.17. Rp.: Analgini 1,0
Adonisidi 5 ml
Natrii bromidi 5,0
Aquae destillatae 180 ml
MDS. По 1 столовой ложке 3 раза в день
Вначале приготавливают раствор солей, а затем добавляют новогаленовый препарат адонизид.
В аптечной практике чаще применяются усложненные прописи. Например, по рецепту 9.18 вначале в воде при нагревании растворяют натрия тетраборат, а после остывания - натрия гидрокарбонат, прибавляют последовательно глицерин, воду горькоминдальную и воду мятную. Ароматные жидкости вводятся в последнюю очередь.
9.18. Rp.: Natrii hydrocarbonatis
Natrii tetraboratis aa 1,5
Aquae Amygdaiarum amararum 3 ml
Glycerini 4,0
Aquae Menthae 4 ml
Aquae destillatae 150 ml
MDS. Жидкость для щелочных ингаляций
Неводные растворы
Главной особенностью растворов для наружного применения является широкое использование, помимо воды, других растворителей, таких как этанол, глицерин, реже применяются растительные и минеральные масла, эфир и хлороформ. Естественно, что чем больше используется растворителей, тем большего разнообразия можно ожидать в рецептуре этой группы растворов. Разнообразие рецептуры неводных растворов вызывается еще и тем, что они применяются для самых различных целей, в связи с чем имеют свои специфические наименования: примочки (fomenta); полоскания (gargarismata); смазывания (giturae); клизмы (clysmata); спринцевания (perlotio: P. vaginales, P. urethrales); обмывания (lotiones); жидкость для тампонов (liquor ad tamponis); жидкость для компрессов (liquor ad compressum); жидкость для ингаляций (liquor ad ingalationis).
В техническом отношении неводные растворы можно разделить на две сходные группы по признаку летучести растворителей: растворы в летучих растворителях (этанол, эфир, хлороформ и т. п.) и растворы в нелетучих растворителях (глицерин, жирные масла и т. п.). Этанол (всегда 90%, если в рецепте не оговорена концентрация) отмеривается по объему, все остальные растворители берут по массе. При изготовлении неводных растворов во флаконы, как правило, вначале высыпают растворимые вещества (удобно через воронку с укороченной трубкой), а затем вводят растворитель; флакон должен быть сухой, так как вода не смешивается с органическими растворителями (кроме этанола и глицерина).
Растворы в летучих растворителях
Спиртовые растворы. При изготовлении спиртовых растворов, так же как и водных растворов, принимается во внимание содержание лекарственных веществ от общего объема раствора. Если их количество менее 5%, то этанола берут столько, сколько прописано в рецепте, так как прирост объема раствора в данном случае незначителен и укладывается в нормы отклонения. Если лекарственных веществ 5% и более, то раствор готовят в мерной посуде или рассчитывают количество этанола с учетом коэффициента увеличения объема по этанолу (табл. 9.1). Пропись рецепта 9.19 содержит лекарственные вещества, находящиеся в разном агрегатном состоянии:
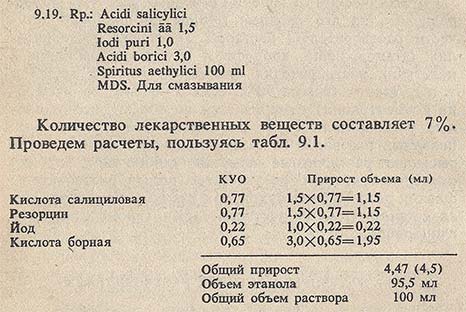
В отпускной флакон помещают отвешенные количества всех ингредиентов, добавляют 95,5 мл 90% этанола, плотно закрывают и взбалтывают до получения прозрачного раствора. Все прописанные вещества растворимы в 90% этаноле.
9.20. Rp.: Mentholi 2,0
Chloroformii 6,0
Olei Eucalypti 8,0
Solutionis Iodi spirituosae 10% 4 ml
Spiritus aethylici 50 ml
MDS. По 15 капель на тампон для вдыхания
В 90% этаноле растворяют вначале ментол, затем добавляют последовательно: эвкалиптовое эфирное масло, хлороформ и настойку йодную. В применении КУО не было надобности (твердых веществ 3%).
В качестве растворителей могут назначаться смеси этанола и хлороформа, этанола и эфира и т. п. Например:
9.21. Rp.: Olei Menthae 5,0
Camphorae 2,0
Aetheris aethylici 10,0
Spiritus aethylici 30 ml
MDS. Для натирания висков при мигрени
Количество лекарственных веществ составляет 7%. Проведем расчеты, пользуясь табл. 9.1.
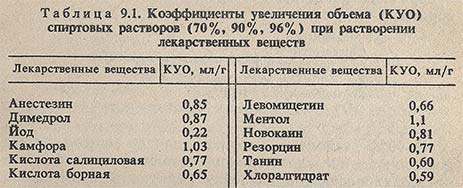
Будет вполне логично, если в этаноле последовательно будут растворены: камфора, мятное эфирное масло и эфир. Растворы в летучих растворителях готовят вдали от огня и не фильтруют. Этанол находится на предметно-количественном учете.
Растворы в нелетучих растворителях
Глицериновые растворы. Глицериновые растворы широко применяются в качестве разных смазываний. Изготовление зависит от того, с какими лекарственными веществами сочетается глицерин. Например, для ускорения растворения натрия тетрабората (рецепт 9.22) применяют глицерин, подогретый до 40-50° С.
9.22. Rp.: Natrii tetraboratis 5,0
Glycerini 30,0
MDS. Для смазывания слизистой оболочки полости рта
Очень часты сочетания йода и калия йодида в глицериновом растворе. К их числу относится раствор Люголя с глицерином (йода - 1 часть, калия йодида - 2 части, глицерина - 94 части, воды - 3 части) и другие прописи.
9.23. Rp.: lodi 0,1
Kalii iodidi 1,0
Glycerini 30,0
MDS. Для тампонов (при вульвовагините)
Растворимость в глицерине: йода 1:200, калия йодида 1:2,5. Калия йодид растворяют в небольшом количестве теплого глицерина, после чего в нем при растирании в ступке растворяют йод. Быстрее и без существенного нарушения прописи можно растворить йод в концентрированном растворе калия йодида (воды 15-20 капель), после чего примешать глицерин.
Масляные растворы. Масляные растворы чаще прописывают для компрессов. Примером может служить раствор салициловой кислоты в персиковом или подсолнечном масле. Салициловую кислоту растворяют в теплом масле.
9.24. Rp.: Acidi salicvlici 2,0
Olei Persicorum 100,0
MDS. Для компрессов (для размягчения кожи)
К водным растворам относятся малоконцентрированные насыщенные растворы неорганических веществ, а также ароматные воды, не содержащие спирта.
Жидкость Бурова (Liquor Burovi, Solutio Aluminii subacetatis). Представляет собой водный раствор основного ацетата алюминия концентрацией 7,6-9,2% и плотностью (σ 20 ) 1,044-1,048. Раньше жидкость Бурова получали с помощью реакции образования гидрата окиси алюминия с его последующим растворением в уксусной кислоте. В последние годы жидкость Бурова производят методом электролиза, разработанным в 1951 г. А. И. Коноваловой. В основе этого метода лежит процесс анодного растворения металлического алюминия в 8% растворе уксусной кислоты при пропускании через него электрического тока (рис. 52). В результате протекает реакция образования основного ацетата алюминия, которая в общем виде может быть выражена следующим образом:
2Аl + 2Н 2 О + 4СН 3 СООН → 3 Н 2 + 2Al (ОН) (СН 3 СОО) 2
Раствор ацетата свинца основного. Свинцовый уксус (Solutio Plumbi subacetatis). Представляет собой водный раствор ацетата свинца основного с содержанием металлического свинца 16,7-17,4% и плотностью 1,225-1,230. При стоянии на воздухе раствор мутнеет вследствие интенсивного поглощения углекислоты воздуха. Препарат получают взаимодействием ацетата свинца и окиси свинца при нагревании.
Сам по себе раствор основного ацетата свинца не применяется. Из него готовят в аптеках свинцовую примочку (Aqua Plumbi) по прописи: 2 части раствора ацетата свинца основного и 98 частей воды. Свинцовая примочка, как и жидкость Бурова, является вяжущим и противовоспалительным средством.
Известковая вода. Раствор гидроокиси кальция (Aqua Calcis. Calcium hydroxydum solutum). Известковая вода - это насыщенный водный раствор гидроокиси кальцияконцентрацией 0,15-0,17%. Получают реакцией гашения жженой извести (кальция окиси) с последующим насыщением раствора гидроокиси кальция па холоду. С этой целью берут 1 часть кальция окиси на 70 частей свежепрокипяченной дистиллированной воды. Вначале заливают порошок небольшим (примерно 1 / 3 ) ее количеством для получения кальция гидроокиси, а затем остальную воду настаивают на кашицеобразной массе кальция гидроокиси до получения насыщенного водного раствора. Готовый препарат представляет собой прозрачную бесцветную жидкость сильно щелочной реакции. Его применяют внутрь в смеси с молоком в детской практике при повышенной кислотности желудочного сока и поносе.
Раствор калия арсенита. Фаулеров раствор мышьяка (Liquor Kalii arsenitis. Liquor arsenicalis Fowleri). Официнальный раствор (ГФХ, статья № 378), представляющий собой водный раствор мышьяковистого ангидрида (которого в препарате должно быть 0,97-1,03%) в смеси с калия карбонатом. Реакция образования препарата имеет вид:
As 2 O 3 + K 2 CO 3 1,5Н 2 О → 2KAs O 2 +CO 2 + 1,5H 2 O.
Для получения раствора калия арсенита 10 частей калия карбоната растворяют в 10 частях кипящей воды, прибавляют 10 частей мышьяковистого ангидрида и жидкость нагревают до кипения (до полного растворения). Далее раствор разбавляют 500 г воды и при перемешивании постепенно добавляют разведенной соляной кислоты до нейтральной реакции раствора, что необходимо для предупреждения образования других солей мышьяка. После нейтрализации к раствору добавляют 90 частей спирта (по объему) и 10 частей камфорного спирта (по объему). Раствор калия арсенита - препарат списка А. Камфорный c пирт добавляют в него с целью быстрого и легкого органолептического опознания.
Сохраняют препарат под замком (шкаф А) в хорошо закупоренных склянках темного стекла. Его назначают при малокровии, неврастении, истощении и хроническом лейкозе.
Противоядие при отравлении металлами (Antidotum metallorum). В качестве противоядия при отравлении тяжелыми металлами применяется раствор состава: магния «сульфата кристаллического - 3,75 части, натрия гидрокарбонсита-12,5 части, натра едкого (в пересчете на 100%) - 1 часть, сероводорода - сколько потребуется, воды - 1000 частей. Технология приготовления раствора заключается в следующем: 500 частей 0,2% раствора натра едкого насыщают газообразным сероводородом, предварительно пропущенным путем барботирования через взвесь кальция карбоната в воде. В других 500 частях воды (свежеприготовленной и охлажденной до 50°С) растворяют натрия гидрокарбонат и магния сульфат. Раствор охлаждают, смешивают с первым раствором, объединенные растворы охлаждают до 2-3°С ниже нуля и вновь насыщают сероводородом, пока его концентрация не достигнет 0,4%, после чего раствор готов к употреблению. Готовый препарат представляет собой раствор лимонно-желтого цвета со слегка зеленоватым оттенком, резким запахом сероводорода и вяжущим, солоновато-горьким вкусом.
Находящиеся в растворе ионы SO 4 2- и S 2- , вступая во взаимодействие с тяжелыми металлами, переводят их в нерастворимые, не всасывающиеся в организме соединения, на чем и основано действие препарата как противоядия.
Ароматные воды (Aquae aromaticae). Представляют собой слабоконцентрированные растворы эфирных масел в воде. Это прозрачные или слабоопалесцирующие жидкости, обладающие запахом растворенного вещества. За редким исключением (укропная и горькоминдальная вода), они не имеют самостоятельного лекарственного назначения и применяются как корригирующие средства (для исправления запаха).
В зависимости от способа получения различают простые и перегнанные ароматные воды.
Простые ароматные воды получают непосредственным растворением соответствующего эфирного масла в воде в соотношении 1:1000 (за исключением розовой воды, которую вследствие сильной пахучести розового масла готовят в соотношении 1:4000). Перед растворением эфирное масло растирают (диспергируют) с тальком и растворяют в теплой (до 60° С) воде. Обе операции необходимы для улучшения процесса растворения. Избыток масла в растворе отфильтровывают через влажный фильтр.
Для повышения стабильности простых ароматных вод к ним рекомендуется добавлять ПАВ, играющие роль солюбилизаторов: твины, спены, этилстеараты и другие вещества, улучшающие растворимость.
Перегнанные ароматные воды готовят методом перегонки, заключающимся в пропускании «острого» водяного пара через эфиромасличное сырье. Процесс перегонки с водяным паром основан на законе Дальтона, в соответствии с которым две несмешивающиеся жидкости перегоняются при более низкой температуре, чем каждая в отдельности, поскольку образование пара таких смесей протекает при равенстве суммы парциальных давлений компонентов смеси и атмосферного давления.
Для получения ароматных вод в перегонный куб помещают эфиромасличное сырье, через которое пропускают водяной пар, увлекающий вместе с собой в конденсатор эфирное масло (рис. 53).
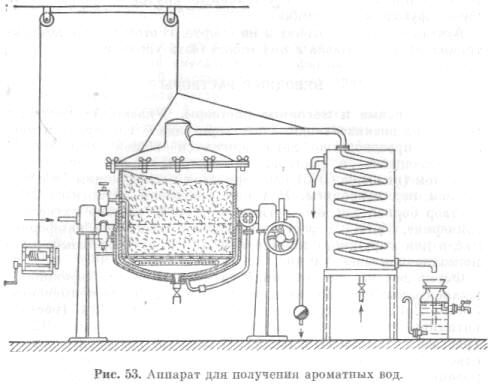
В конденсаторе, охлаждаемом холодной водой, пары воды и эфирного масла конденсируются и стекают в приемник в виде готовой ароматной воды. В случае, если при перегонке образуется излишек эфирного масла, не растворяющийся в воде, его сливают в отдельные приемники.
Из перегнанных ароматных вод в фармацевтической практике более или менее широкое применение находят горькоминдальная вода (Aqua Amygdalarum amararum) и укропнаявода (Aqua Foeniculi), применяемые внутрь с целью улучшения функций кишечника.
Ароматные воды готовят и на спирте. В этом случае концентрация эфирного масла в них может быть увеличена.
Невозможно переоценить роль воды в естественных природных и технических процессах. Ничто не обходится без её участия. Вода и водные растворы широко применяются в производстве современных минеральных и полимерных строительных материалов. Проблемы водоснабжения и во-доотведения - важнейшие в современном жизнеобеспечении. Вода - главная везде и всегда. Поэтому курс «Химия в строительстве» начинается с изложения свойств воды и вопросов, связанных с использованием её в технологии строительства.
Вода в природе находится в непрерывном взаимодействии с окружающей средой и представляет собой раствор многих веществ, в том числе солей, газов, а также веществ органического происхождения.
Молекулы воды могут вступать во взаимодействие с ионами или молекулами растворённых веществ, образуя соединения - гидраты. Такая гид-ратная вода иногда очень прочно связана с растворённым веществом и при выделении из раствора входит в состав кристаллов. Кристаллические вещества, содержащие в своем составе воду, называют кристаллогидратами. Вода, входящая в структуру таких кристаллов, называется кристаллизационной. Состав кристаллогидратов обычно выражают, указывая число молекул кристаллизационной воды, приходящейся на одну молекулу вещества, например формула кристаллогидрата сульфата меди - CuS0 4 ∙ 5Н 2 0. Иногда одно вещество способно образовывать кристаллогидраты, содержащие различное число молекул кристаллизационной воды.
Молекула воды состоит из двух атомов водорода и одного атома кислорода (Н 2 О), соединённых ковалентными полярными связями, угол между которыми равен 104,54°. Молекула воды является полярной: та часть молекулы, где находится атом кислорода, имеет некоторый отрицательный заряд, а та часть, где располагаются атомы водорода, - равный по величине положительный заряд (обычно частичные заряды в подобных случаях обозначают символами σ + и σ-). То есть молекула воды - диполь.
За счёт взаимного электростатического притяжения отрицательно заряженных атомов кислорода и положительно заряженных атомов водорода разных молекул между ними образуются множественные разнонаправленные водородные связи. Эти связи объединяют молекулы воды друг с другом и объясняют различные аномальные свойства воды. Молекулы в воде
находятся не в индивидуальном состоянии, а образуют ассоциаты (соединения) из множества молекул Н 2 0 различного состава и структуры, объединённых водородными связями.
Вода в природе встречается в трёх агрегатных состояниях - жидком, твёрдом (лёд) и газообразном (пары воды). При этом температуры плавления и кипения воды являются аномально высокими по сравнению с другими веществами сравнимой или даже более высокой молекулярной массы.
Ожидаемая температура кипения воды составляет всего 90°. Однако реальная температура кипения (100°) намного выше. Это объясняют водородными связями, объединяющими все молекулы. Разрыв этих связей требует дополнительных затрат энергии. Жидкая вода имеет наибольшую плотность (1000 кг/м 3) при 4°. При повышении температуры плотность воды снижается за счёт постепенного разрыва части водородных связей. Но даже при испарении молекулы воды переходят в газовую фазу не по одной, а целыми ассоциатами (группами), состоящими из молекул, объединённых сохраняющимися водородными связями.
Если воду освободить от взвешенных частиц и растворенных газов, а затем равномерно нагревать, не встряхивая, то можно достичь температуры значительно выше 100°, прежде чем вода бурно закипит. При охлаждении воды ниже 0° она также не всегда сразу замерзает. Для начала кипения или кристаллизации необходимы так называемые "зародыши", которыми могут быть мелкие кристаллики или пылинки, находящиеся в жидкости. Если же таковых нет, то может произойти перегрев или переохлаждение воды.
В твёрдом состоянии вода (лёд) имеет кристаллическую решётку, в которой каждая молекула окружена четырьмя другими молекулами воды. В результате лёд является веществом с низкой плотностью (900 кг/м 3). При его плавлении разрывается около 15% имеющихся водородных связей, а пустоты внутри каркаса льда заполняются молекулами воды. Поэтому плотность жидкой воды превышает плотность льда, и плавление льда сопровождается уменьшением объёма до 9- 10%. При замерзании воды, наоборот, происходит увеличение объёма. Необходимо учитывать, что при замерзании воды в насыщенных ею материалах, ёмкостях или трубах возникающее при увеличении объёма давление настолько велико, что вызывает их разрушение.
Чистая вода характеризуется наибольшей из всех жидких и твёрдых веществ (за исключением аммиака) теплоёмкостью. Поэтому для нагревания воды требуется затратить больше тепла, чем для нагревания равного по массе количества какой-либо другой жидкости или твёрдого тела (при охлаждении вода отдаёт больше тепла, чем равное количество любого твёрдого и жидкого вещества).
Теплопроводность воды также значительно больше, чем у других жидкостей - 0,63 Вт/(м К). Электропроводность же воды очень мала, но заметно возрастает при повышении температуры и давления. С увеличением температуры снижается и вязкость воды (при 20° равна 1,01 10 3 Пас).




